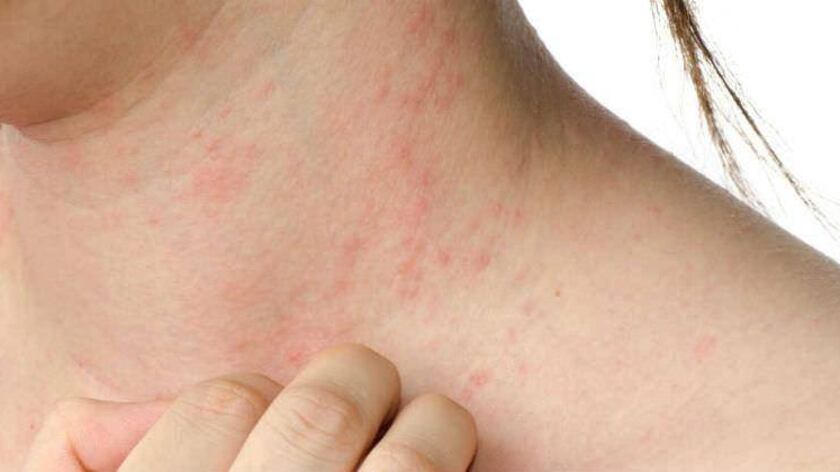
NORTH CHICAGO, Ill., 14 de enero de 2022 – AbbVie (NYSE: ABBV) anunció hoy que la Administración Federal de Drogas y Alimentos (FDA, por sus siglas en inglés) de los Estados Unidos aprobó RINVOQ® (upadacitinib) para el tratamiento de dermatitis atópica de moderada a severa en adultos y niños de 12 años o más cuya enfermedad no respondió a tratamiento previo y no se controla con otras píldoras o inyecciones, entre estos, medicamentos biológicos, o cuando no se recomienda el uso de otras píldoras o inyecciones1. La dosis de 15 mg de RINVOQ una vez al día puede iniciarse en adultos y niños de 12 años o más que pesan al menos 40 kg1. En estos niños y adultos menores de 65 años que no logran una respuesta adecuada, la dosis puede aumentarse a 30 mg una vez al día1.
PUBLICIDAD
“Temprano en mi carrera como alergista, pude ver cuán implacable puede ser el picor y la erupción en mis pacientes con dermatitis atópica de moderada a severa, pero tenía una limitación en cuanto a las opciones de tratamiento que tenía para ofrecerles a personas cuya enfermedad no podía controlarse de manera adecuada con terapia sistémica”, expresó Thomas Hudson, M.D., vicepresidente sénior de investigación y desarrollo, y oficial científico principal de AbbVie. “Esta aprobación adicional de RINVOQ provee una opción oral de una vez al día que puede mejorar de manera significativa el picor debilitante y los síntomas cutáneos de la dermatitis atópica. Además, es un momento de orgullo para AbbVie ya que podemos continuar nuestros esfuerzos para mejorar el cuidado de esta enfermedad y otras enfermedades crónicas mediadas por la inmunidad.”
La aprobación de la FDA está sustentada en los datos de eficacia y seguridad de uno de los más amplios programas de fase 3 de registro para la dermatitis atópica, que cuenta con más de 2,500 pacientes evaluados entre tres estudios. Cerca del 52 por ciento de los pacientes había estado expuesto a tratamiento sistémico previo para la dermatitis atópica. Estos estudios evaluaron la eficacia y la seguridad de la monoterapia con RINVOQ (Measure Up 1 y 2) y con corticoesteroides tópicos (AD Up) en comparación con placebo en adultos y niños de 12 años o más con dermatitis atópica de moderada a severa2-3.
“A pesar de las terapias disponibles, muchas personas con dermatitis atópica de moderada a severa se encuentran en un ciclo interminable entre picor y rascado”, explicó Emma Guttman-Yassky, M.D., Ph.D., Profesora de Waldman y directora del Sistema de Dermatología de la Escuela de Medicina de Icahn en Mount Sinai en la ciudad de Nueva York*. “En los estudios clínicos, el upadacitinib demostró una respuesta contundente entre los síntomas de picor y rascado que puede ayudar a evolucionar los objetivos de tratamiento de las personas que no han logrado un control adecuado de su enfermedad. Y como píldora oral con dos concentraciones de dosis, el upadacitinib es una adición al arsenal que tienen los médicos que se esfuerzan por hacer una diferencia significativa para sus pacientes con dermatitis atópica de moderada a severa.”
PUBLICIDAD
Respuesta clínica en la semana 161-3
- Entre los tres estudios fundamentales (pivotal) de dermatitis atópica, RINVOQ (15 mg y 30 mg, una vez al día), en monoterapia y con corticoesteroides tópicos, alcanzó los criterios de valoración primarios y secundarios en la semana 16, y algunos pacientes lograron niveles más altos de aclaramiento de la piel (EASI 90 y 100).
| Datos de la semana 16 | |||||||||
| Measure Up 1 (MU1) | Measure Up 2 (MU2) | AD Up (AU) | |||||||
| RINVOQ 15 mg (n=281) |
RINVOQ 30 mg (n=285) |
Placebo (n=281) |
RINVOQ 15 mg (n=276) |
RINVOQ 30 mg (n=282) |
Placebo (n=278) |
RINVOQ 15 mg más CEST
(n=300) |
RINVOQ 30 mg más CEST
(n=297) |
Placebo más CEST (n=304) |
|
| EASI 75* | 70% | 80% | 16% | 60% | 73% | 13% | 65% | 77% | 26% |
| vIGA-AD 0/1* | 48% | 62% | 8% | 39% | 52% | 5% | 40% | 59% | 11% |
| EASI 90 | 53% | 66% | 8% | 42% | 58% | 5% | 43% | 63% | 13% |
| EASI 100 | 17% | 27% | 2% | 14% | 19% | 1% | 12%** | 23% | 1% |
| ECN del Peor Prurito ≥4 | 52% | 60% | 12% | 42% | 60% | 9% | 52% | 64% | 15% |
| *Los criterios de valoración coprimarios fueron EASI 75 y vIGA-AD 0/1 en la semana 16. No se muestran todos los criterios de valoración secundarios. | |||||||||
| **Criterio de valoración no controlado para multiplicidad. | |||||||||
| EASI 75 se define como una reducción de al menos un 75 por ciento del Área del Eczema e Índice de Severidad. EASI 90 y 100 se definen como una reducción de al menos un 90 por ciento o un 100 por ciento del Área del Eczema e Índice de Severidad. | |||||||||
| vIGA-AD 0/1 se define como una Evaluación Global del Investigador validada para Dermatitis Atópica de aclaramiento total o casi total (0/1) con al menos dos grados de reducción desde el inicio. | |||||||||
| ECN del Peor Prurito ≥4 se define como la proporción de sujetos que logran una mejora en la Escala de Calificación Numérica (NRS, por sus siglas en inglés) del Peor Prurito ≥4 puntos en sujetos con un puntaje ≥4 en la Escala de Calificación Numérica del Peor Prurito desde el inicio. | |||||||||